
任何疾病(包括肾脏及某些全身性疾病),如能使肾单位发生进行性破坏,则在数月、数年或更长的时间后,残存的肾单位不能充分排出代谢废物和维持内环境稳定,因而体内出现代谢废物的潴留和水、电解质与酸碱平衡紊乱以及肾内分泌功能障碍,这种情况称之为慢性肾功能不全(chronic renal insufficiency,CRI)。
一、病因(Etiology)
凡能引起慢性肾实质破坏的疾病都可导致CRI,其中以慢性肾小球肾炎最为多见 。慢性肾功能不全的病因分类如下:
1.肾实质病变:慢性肾小球肾炎、慢性肾盂肾炎、系统性红斑狼疮、多囊肾、肾结核、肾肿瘤等。
2.肾血管疾患:良性/恶性肾小动脉硬化、糖尿病肾小动脉硬化症、结节性动脉周围炎等 。
3.慢性尿路梗阻:尿路结石、肿瘤、前列腺肥大等
二、发病过程(Progress)
CRI的病程进展是进行性加重的,可分为代偿期和失代偿期。
(一)代偿期(Compensation stage)
由于肾脏具有强大的代偿能力,在慢性肾脏疾病的开始阶段,肾实质破坏较轻,未受损的肾单位发挥代偿功能,因此,肾泌尿功能基本正常,尚能维持内环境的稳定,无临床症状。内生肌酐清除率在正常值的30%以上,血液生化指标无异常。但肾脏储备能力降低,在突然增加肾脏调节负荷(如感染和水、钠、钾负荷突然增加时),则发生内环境紊乱。
(二)失代偿期(Discompensation stage)
包括肾功能不全期、肾功能衰竭期、尿毒症期。
| 慢性肾功能不全的发展阶段 | |||||||||||||||||||||||
|
三、发病机制(Pathogenesis)
(一)健存肾单位学说(Intact nephron hypothesis)
在慢性肾疾病时,很多肾单位不断遭受破坏而丧失其功能,残存的部分肾单位轻度受损或仍属正常,称之为健存肾单位(intact nephron)。在代偿期,健存肾单位发生代偿性肥大,通过增强其功能来进行代偿,维持内环境稳定。随着疾病的进展,健存肾单位日益减少以致无法代偿时,临床上出现肾功能不全的症状。
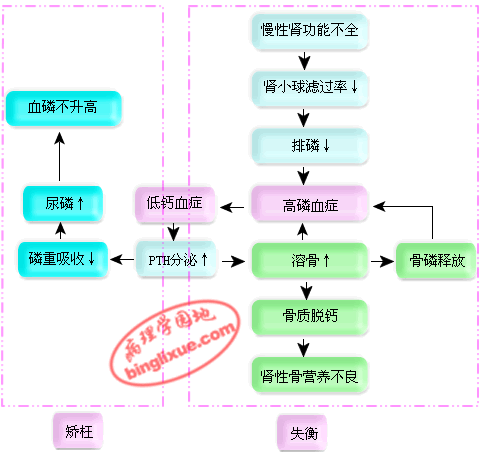
(二)矫枉失衡学说(Trade-off hypothesis)
慢性肾脏疾病晚期,随着健存肾单位和肾小球滤过率的进行性减少,体内某些溶质(如磷)增多。作为机体的代偿性反应,可通过分泌某些体液因子(如甲状旁腺素,PTH)来提高这种溶质在单个肾单位的排泄率。这种体液因子的适应性分泌增多虽然通过加强上述某种溶质的排泄而使其在体内的滞留得到了"矫正",但这种体液因子分泌增多会对机体其它一些生理功能产生不良影响(如PTH的溶骨作用),使内环境产生另外一些"失衡"。
 |
(三)肾小球过度滤过学说(Glomerular hyperfiltration hypothesis)
部分肾单位功能丧失后,健存肾单位的肾小球毛细血管血压和血流量增加,从而导致单个健存肾单位的肾小球滤过率增多。长期负荷过重会导致肾小球发生纤维化和硬化,因而促进肾功能不全的发生。
(四)肾小管-间质损伤(Renal tubule-interstitium injury)
慢性肾脏疾病患者肾形态学研究表明,肾功能损害程度与慢性肾小管-间质的病理变化关系密切。残存肾单位的肾小管,尤其是近端肾小管,在慢性肾衰竭时发生代谢亢进,细胞内钙含量增多,自由基产生增多,导致肾小管和间质细胞的损伤。
肾小管-间质的纤维化均伴有肾小管的萎缩,因此,肾小管-间质的纤维化是慢性肾功能衰竭的主要原因。因为:①间质的纤维化和肾小管萎缩可导致球后毛细血管的阻塞,毛细血管流量减少,肾小球滤过率降低;②肾小管萎缩导致无小管肾小球形成,血流不经滤过直接经静脉回流,使肾小球滤过率进一步下降。
四、机能及代谢的变化(Alteration of function and metabolism)
(一)泌尿功能障碍(Uresis dysfunction)
1.尿量的变化(Alteration of urine volume)
(1)夜尿(nocturia) 正常成年人每日尿量约为1500ml,白天尿量约占总尿量的2/3。CRI患者早期即有夜间排尿增多的症状,甚至超过白天尿量,称为夜尿。机制:平卧后肾血流量增加导致原尿生成增多及肾小管对水的重吸收减少。
(2)多尿(polyuria) 24小时尿量超过2000ml称为多尿。慢性肾功能衰竭早期,24h尿量一般在2000~3000ml。
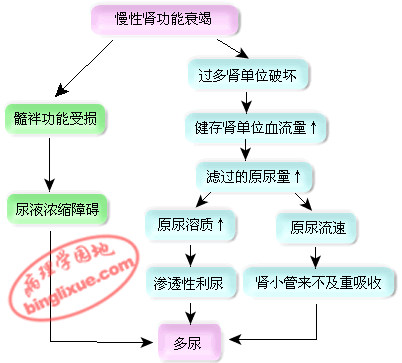 |
(3)少尿(oliguria) 当健存肾单位极度减少,尽管残存的单个肾单位生成尿液仍多,但每日终尿量可少于400ml。
2.尿渗透压的变化(Alteration of urine osmotic pressure)
在早期CRI患者,肾浓缩能力减退而稀释功能正常,因而出现低渗尿。随着病情发展,肾浓缩和稀释功能均丧失,终尿的渗透压接近血浆晶体渗透压,尿比重固定在1.008~1.012,尿渗透压为266~300mmol/L,称为等渗尿。
3.尿液成分的变化(Alteration of urine component)
(1)蛋白尿(proteinuria):很多肾疾患可使肾小球滤过膜通透性增强,致使肾小球滤出蛋白增多;或肾小球滤过功能正常,但因肾小管上皮细胞受损,使滤过的蛋白重吸收减少;或两者兼而有之。
(2)血尿和脓尿:一些慢性肾疾病如肾小球肾炎,基底膜出现局灶性溶解破坏,通透性增高而导致血液中的红、白细胞从肾小球滤过,出现血尿和脓尿。
(二)氮质血症(Azotemia)
1.血浆尿素氮(Blood urea nitrogen,BUN)
在CRI早期,当肾小球滤过率减少到正常值的40%以前,BUN仍在正常范围内。当肾小球滤过率减少到正常值的20%以下时,血中BUN可高达71.4mmol/L(>200mg/dl)。由此可见,BUN浓度的变化并不是反映肾功能改变的敏感指标,而且BUN值还与外源性(与蛋白质摄入量)及内源性(感染、肾上腺皮质激素、胃肠道出血等)尿素负荷的大小有关,因此根据BUN值判断肾功能变化时,应考虑这些尿素负荷的影响。
2.血浆肌酐(Creatinine)
肌酐浓度主要取决于肌肉磷酸肌酸分解而产生的肌酐量和肾脏排出肌酐的功能,与外源性的蛋白摄入无关。与BUN相似,肌酐浓度的变化,只是在CRI晚期才明显升高。因此临床上必须同时测定血浆肌酐浓度和尿肌酐排泄率,根据计算的肌酐的清除率(creatinine clearance rate)(尿中肌酐浓度×每分钟尿量/血浆肌酐浓度)反映肾小球滤过率。
3.血浆尿酸氮(Blood uric acid nitrogen)
CRI时,血浆尿素氮虽有一定程度的升高,但较尿素、肌酐为轻,这主要与肾远曲小管分泌尿酸(uric acid)增多和肠道尿酸分解增强有关。
(三)水、电解质及酸碱平衡紊乱(Disturbance of water,electrolyte and acid-base)
1.水代谢障碍(Disturbance of water)
CRI时水代谢障碍的特点是肾脏对水负荷变化的调节适应能力减退。多尿如不及时补充水,会导致脱水;水补充过多,会造成水潴留,甚至发生水中毒;肾单位极度减少时,肾小球滤过率明显下降,因少尿而导致水肿的发生。因此CRI时必须严格观察和调整水的出入量。
2.钠代谢障碍(Disturbance of natrium)
CRI时的钠代谢障碍,一方面可以继发于水代谢障碍而表现为血钠过高或过低;另一方面肾脏对钠平衡的调节适应能力降低。CRI患者的肾为"失盐性肾",尿钠含量很高,可能是因为①渗透性利尿。慢性肾功能衰竭伴有氮质血症,流经健存肾单位的原尿中溶质(主要为尿素)浓度较高,钠、水重吸收减少,大量的钠随尿排出。②CRI时体内甲基胍蓄积,可抑制肾小管对钠的重吸收减少。如过分限制钠的摄入,可导致低钠血症;如钠摄入过多,超过健存肾单位对钠的代谢能力,可导致钠水潴留。
3.钾代谢障碍(Disturbance of kalium)
CRI早期,由于尿量不减少,血钾可长期维持正常水平。但长期使用排钾性利尿剂、厌食、呕吐、腹泻等还可导致低钾血症。CRI晚期,由于少尿、摄入富含钾的食物、输入库存血、酸中毒、感染等则可引起高钾血症。
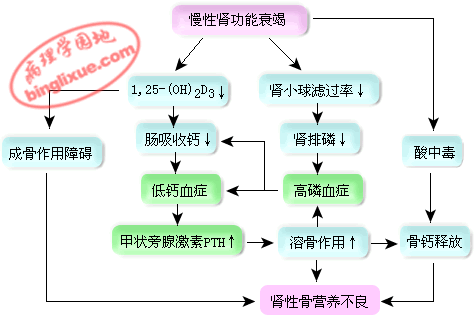
4.钙磷代谢障碍(Disturbance of calcium and phosphorus)
(1)血磷增高 在CRI早期,由于肾小球滤过率下降,血磷暂时上升,但由于钙磷乘积为一常数,血中游离钙减少,刺激甲状旁腺分泌甲状旁腺激素(PTH)。根据矫枉失衡学说,PTH就是针对血磷滤过减少而在血液中增多的体液因子,通过抑制肾小管对磷的重吸收,使磷排出增多。到CRI晚期,由于肾小球滤过率极度下降,继发性PTH分泌增多已不能使磷充分排出,故血磷水平显著升高。PTH的增多又加强溶骨活动,使骨磷释放增多,从而形成恶性循环,使血磷水平不断上升。
(2)血钙降低 在CRI时出现低血钙,其原因是:①血磷升高:由于钙磷乘积为一常数,血磷升高必然导致血钙降低,同时血磷过高时,肠道分泌磷酸根增多,可在肠内与食物中的钙结合形成不易溶解的磷酸钙,妨碍钙的吸收;②维生素D代谢障碍:由于肾实质破坏,25-(OH)-D3羟化为1,25-(OH)2-D3功能发生障碍,肠道对钙的吸收因而减少;③体内某些毒性物质的滞留可使肠粘膜受损,钙的吸收因而减少;④血磷升高刺激甲状旁腺细胞分泌降钙素,抑制肠道对钙的吸收。
(3)肾性骨营养不良 肾性骨营养不良(renal osteodystrophy)是指在慢性肾功能不全时,由于钙磷代谢障碍、继发性甲状腺旁功能亢进、维生素D代谢障碍、酸中毒等所引起的骨病,包括纤维性骨炎、骨质疏松、骨硬化和骨软化。
 |
5.代谢性酸中毒(Metabolic acidosis)
CRI早期,酸中毒的产生主要是由于肾小管上皮细胞NH3生成障碍使H+分泌减少所致。由于泌H+减少,Na+-H+交换也减少,故NaHCO3重吸收也减少。当肾小球滤过率降至正常人的20%以下时,血浆中固定酸不能由尿中排出,特别是硫酸、磷酸等在体内积蓄。
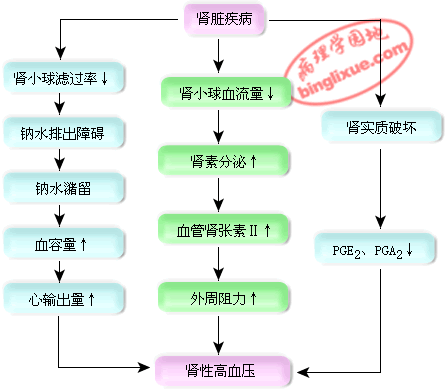
(四)肾性高血压(Renal hypertension)
因肾实质病变引起的血压升高称为高血压。其发生机制可能与下列因素有关:
1.肾素-血管紧张素系统的活动增强 部分肾疾病患者,由于肾相对缺血,激活肾素-血管紧张素系统,使血管紧张素Ⅱ增多,它可收缩小动脉,引起高血压,称为肾素依赖性高血压(renin-dependent hypertension)。
2.钠水潴留 CRI时,肾泌尿功能降低导致钠、水在体内潴留,血容量和心输出量增加,产生高血压,此种高血压称为钠依赖性高血压(sodium-dependent hypertension)。
3.肾分泌的抗高血压物质减少正常肾髓质能合成多种血管舒张物质,如前列腺素E2和A2、缓激肽等,当肾实质破坏时,这些物质分泌减少,导致血压升高。
 |
(五)肾性贫血(Renal anemia)
慢性肾脏疾病经常伴有贫血,其发生机制是:
1.促红细胞生成素减少 由于肾实质破坏,促红细胞生成素产生减少,使骨髓干细胞形成红细胞受到抑制,红细胞生成减少。
2.血液中毒性物质蓄积 如甲基胍可抑制骨髓造血功能。
3.红细胞破坏增多 大量毒性物质潴留,红细胞膜上钠泵活性受到抑制,导致钠不能排出,红细胞处于高渗状态,细胞膜脆性增加,易于溶血。
4.铁的缺乏 肠道对铁吸收减少以及胃肠道出血造成铁的丢失。
5.出血 CRI患者常有出血倾向,经常出血可加重贫血。
(六)出血倾向(Hemorrhagic tendency)
约20%的慢性肾功能衰竭患者,在疾病过程中存在出血现象,其中以鼻衄和胃肠道出血最为常见。目前认为,出血是由于血小板质的变化而非数量减少所引起。其原因可能与某些毒性物质抑制血小板第3因子释放有关。