
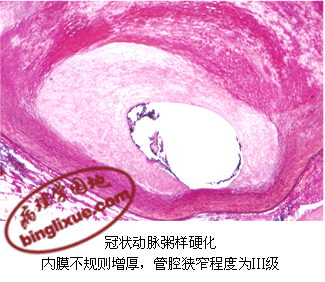
一、冠状动脉粥样硬化症
冠状动脉粥样硬化好发部位以左冠状动脉前降支最多,其余依次为右主干、左主干或左旋支、后旋支。病变常呈节段性,多发生于血管的心壁侧,斑块多呈新月形,管腔呈偏心性不同程度的狭窄。按管腔狭窄程度可分为4级:Ⅰ级,≤25%;Ⅱ级,26%~50%;Ⅲ级,51%~75%;Ⅳ级,>76%。
冠状动脉粥样硬化常伴发冠状动脉痉挛,痉挛可使原有的管腔狭窄程度加剧,甚至导致供血的中断,引起心肌缺血及相应的心脏病变(如心绞痛、心肌梗死等),并可成为心源性猝死的原因。
二、冠状动脉性心脏病(冠心病)
冠状动脉性心脏病(coronary artery heart disease, CHD)简称冠心病,是指因冠状动脉狭窄、供血不足而引起的心肌机能障碍和(或)器质性病变,故又称缺血性心肌病(IHD)。CHD是多种冠状动脉病的结果,但冠状动脉粥样硬化占冠状动脉性心脏病的绝大多数(95%-99%)。因此,习惯上把CHD视为冠状动脉粥样硬化性心脏病(coronary atherosclerotic heart disease)同义词。
CHD的原因:①冠状动脉供血不足:主要为冠状动脉粥样硬化斑块、继发的复合性病变和冠状动脉痉挛引起的管腔狭窄,是CHD的最常见原因。②心肌耗氧量剧增:当冠状动脉不同程度的狭窄时,由于各种原因导致心肌负荷增加(如血压骤升、情绪激动、心动过速等),使冠状动脉供血相对不足,引发CHD。
(一)心绞痛
心绞痛(angina pectoris,AP)是冠状动脉供血不足和(或)心肌耗氧量骤增致使心肌急性、暂时性缺血、缺氧所引起的临床综合征。表现为胸骨后部位压榨性或紧缩性疼痛感,常放射至左肩和左臂。每次发作3~5min,可数日一次,也可一日数次。可因休息或用硝酸酯剂而缓解消失。
临床上心绞痛分为:①稳定性AP(stable angina pectoris)又称轻型心绞痛,一般不发作,可稳定数月,仅在重体力、脑力劳动或其他原因所致一过性心肌耗氧量增高时出现症状;②不稳定性AP(unstable angina pectoris)临床上颇不稳定,在负荷时、休息时均可发作。发作强度和频度逐渐增加,患者大多至少有一支冠状动脉主干近侧端高度狭窄。③变异性AP(variant angina pectoris)又称Prinzmetal心绞痛,常于休息或梦醒时因冠状动脉收缩性增加而引起的AP。多无明显诱因,心电图与其它型AP相反,显示有关导联ST段抬高,主要是冠状动脉痉挛引起的。虽然AP程度重,持续时间或长或短,但很少导致心肌梗死。此型AP对血管扩张药如硝酸甘油反应良好。
(二)心肌梗死
心肌梗死(myocardial infarction,MI)是指急性、持续性缺血、缺氧(冠状动脉功能不全)所引起的心肌坏死,临床上多有剧烈而持久的胸骨后疼痛,休息及硝酸酯类药物不能完全缓解,伴白细胞增高、发热、血沉加快,血清心肌酶活性增高及进行性心电图变化,可并发心律失常、休克或心力衰竭。
1.原因 MI大多数由冠状动脉粥样硬化引起。在此基础上并发血栓形成、斑块内出血或持续性痉挛使冠状动脉血流进一步减少或中断,过度劳累使心脏负荷加重,导致心肌缺血。
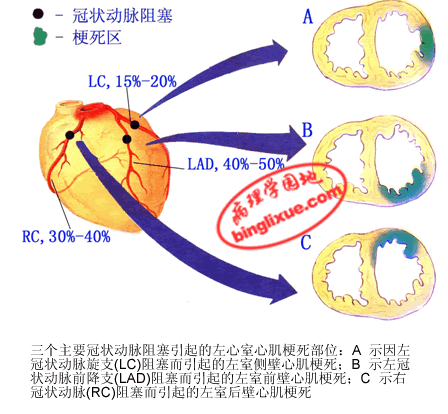
2.好发部位和范围 MI的部位与冠状动脉供血区域一致。MI多发生在左心室,其中约40%~50%的MI发生于左心室前壁、心尖部及室间隔前2/3,这些部位是左冠状动脉前降支供血区:约30%~40%发生于左心室后壁、室间隔后1/3及右心室大部,相当于右冠状动脉供血区:15%~20%见于左冠状动脉旋支供血的左室侧壁。心肌梗死极少累及心房。
3.类型 根据梗死灶占心室壁的厚度将MI分为两型:①区域性MI(regional myocardial infarction),亦称透壁性MI(transmural myocardial infarction),累及心室壁全层,梗死部位与闭塞的冠状动脉支供血区一致,梗死面积大小不一,多在2.5~10cm2之间。该型梗死远比心内膜下梗死常见。如梗死未累及全层而深达室壁2/3以上则称厚壁梗死。②心内膜下MI(subendocardial myocardial infarction),指梗死仅累及心室壁内层1/3的心肌,并波及肉柱及乳头肌。常为多发性、小灶状坏死,不规则地分布于左心室四周,严重者融合或累及整个左心室内膜下心肌引起环状梗死(circumferential infarction)。
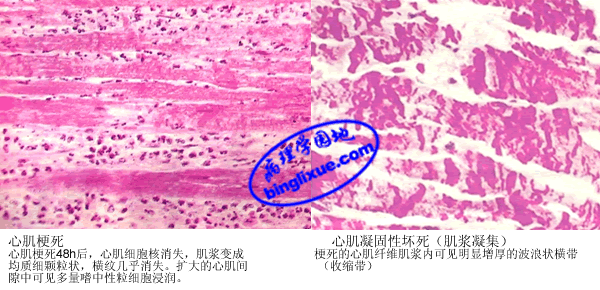
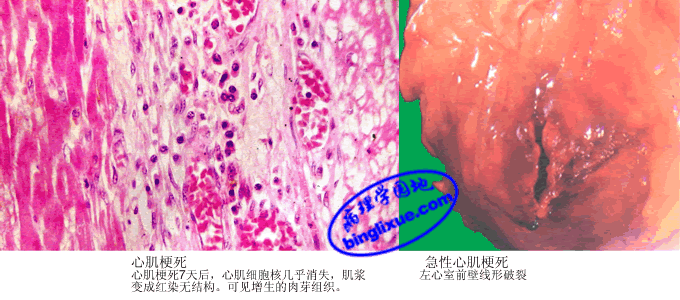
4.病理变化 MI的形态变化是一个动态演变过程。心肌缺血后不久,电镜下表现为心肌纤维肌浆水肿,轻度的线粒体肿胀和糖原减少,是可逆性损伤。心肌缺血1/2~2 hr后,心肌纤维发生不可逆性损伤,表现为线粒体明显肿胀,嵴不规则和不定形基质致密物的出现等。梗死后4~12 hr内,基本无肉眼可见的变化,在四唑氮蓝(triphenyltetrazolium chloride,TTC)染色时,梗死心肌因氧化酶的缺乏呈无色,而未梗死心肌呈蓝色。光镜下,心肌纤维出现凝固性坏死变化,水肿伴有出血,嗜中性粒细胞开始浸润,染色质凝集在核膜下。18~24 hr时,梗死灶呈苍白色。光镜下,梗死边缘的心肌纤维变长呈波浪状和肌浆凝集,梗死的心肌肌浆明显红染。24~72 hr时,梗死灶呈伴有污点的苍白色,有时充血明显。光镜下,整个心肌纤维凝固性坏死,核消失,横纹消失,肌浆变成不规则粗颗粒状,肌纤维呈条索状,梗死区炎症反应明显,嗜中性粒细胞浸润达高峰,3~7天时,梗死灶变软,呈淡黄*色或黄褐色,梗死灶外周出现充血出血带。光镜下,心肌纤维肿胀、空泡变,胞浆内出现颗粒及不规则横带(收缩带),在梗死灶周边带开始肉芽组织增生,梗死区开始机化。间质水肿,常见出血。10天时,梗死灶凹陷,呈黄*色或红褐色,软化明显并可见血管化的边缘,周围充血带更明显。光镜下,吞噬细胞吞噬作用明显,在梗死灶边缘可见有显著的肉芽组织。几周到几个月后,胶原蛋白进行性沉积在梗死灶内,肉芽组织增生并机化形成地图形白色瘢痕。
MI后,血和尿中肌红蛋白升高,谷氨酸-草酰乙酸转氨酶(glutamic oxaloacetic transaminase, GOT)、肌酸磷酸激酶(creatine phosphokinase,CPK)及乳酸脱氢酶(lactate dehydrogenase,LDH)的血浓度升高,其中尤以CPK和LDH对MI的诊断是敏感而可靠的指标。另外,CPK的MB同功酶(CPK-MB)的大量增加对诊断MI有特异性参考意义。
5.并发症
(1)心脏破裂:约占致死病例3%~13%。常发生在MI后1~2周内,好发于左心室前壁下1/3处。原因是梗死灶失去弹性,心肌坏死、中性粒细胞和单核细胞释放水解酶所致的酶性溶解作用,导致心壁破裂,心室内血液进人心包,造成心包填塞而引起急死。另外室间隔破裂,左心室血液流入右心室,引起右心功能不全。左心室乳头肌断裂,可以引起急性二尖瓣关闭不全,导致急性左心衰竭。
(2)室壁瘤:约占梗死病例10~38%。可发生在梗死早期或梗死灶已纤维化的愈合期。由梗死心肌或瘢痕组织在心室内压力作用下,局限性的向外膨隆而形成室壁瘤。室壁瘤可继发附壁血栓、心律不齐及心功能不全。
(3)附壁血栓形成:多见于左心室。由于梗死区内膜粗糙,室壁瘤处及心室纤维性颤动时出现涡流等原因而诱发血栓形成。较小的血栓可发生机化,但多数血栓因心脏舒缩而脱落引起动脉系统栓塞。
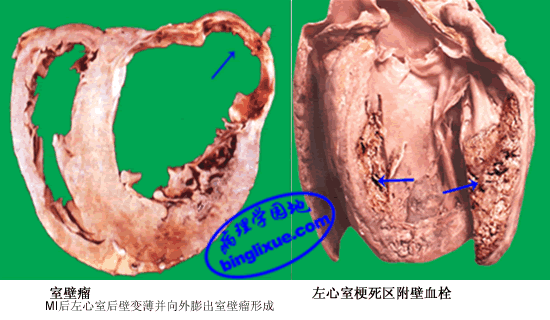
MI后左心室后壁变薄并向外膨出室壁瘤形成
(4)急性心包炎:透壁性梗死,常在MI后发生浆液性或浆液纤维素性心包炎。约占MI的15%,常发生在MI后2~4天。
(5)心律失常:约占MI的75%~95%。MI累及传导系统,引起传导紊乱,有些可导致心脏急停、猝死。
(6)心功能不全:梗死区心肌收缩力丧失,引起左心、右心或全心衰竭,是患者死亡的最常见原因,约占MI的60%。
(7)心源性休克:约占MI的10%~20%。MI面积>40%时,心肌收缩力极度减弱,心输出量显著减少,可引起心源性休克,导致患者死亡。
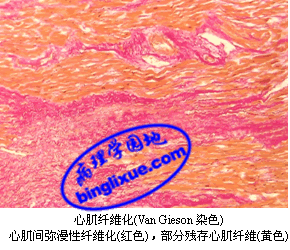
(三)心肌纤维化
心肌纤维化(myocardial fibrosis)是由中~重度的冠状动脉粥样硬化性狭窄引起心肌纤维持续性和(或)反复加重的心肌缺血缺氧所产生的结果,导致逐渐发展为心力衰竭的IHD,即慢性缺血性心脏病(chronic ischemic heart disease)。
肉眼观:心脏体积增大,重量增加,所有心腔扩张;心壁厚度可能正常,伴有多灶性白色纤维条索或条块,甚至透壁性瘢痕;心内膜增厚并失去正常光泽,有时可见机化的附壁性血栓。
光镜下,广泛性、多灶性心肌纤维化,伴邻近心肌纤维萎缩和(或)肥大,常有部分心肌纤维肌浆空泡化,尤以内膜下区明显,以及陈旧性MI或瘢痕灶。临床上可表现为心律失常或心力衰竭。
(四)心源性猝死
心源性猝死(sudden cardiac death)是指IHD而引起的出乎意料的突发性死亡,通常是由于心室纤维性颤动而发生。多见于39~49岁患者,男性多于女性。可在某些诱因作用下发作,如饮酒、吸烟、劳累、运动、争吵和斗殴等,也可在无人察觉的情况下,死于夜间。